卵巢功能及周期性变化
卵巢具有生殖和内分泌双重功。
始基卵泡是女性的基本生殖单位。
青春期至绝经期卵巢形态和功能呈现周期性变化。
卵巢周期历经卵泡的发育与成熟、排卵、黄体形成与退化。
雌激素和孕激素的生理作用既有协同又有拮抗。
在女性一生的不同阶段,卵巢的功能和形态有较大变化。
(一)卵巢的功能卵巢为女性的性腺,其主要功能为产生卵子并排卵和分泌女性激素,分别称为卵巢的生殖功能和内分泌功能。
(二)卵巢的周期性变化
卵泡自胚胎形成后即进入自主发育和闭锁的轨道,此过程不依赖于促性腺激素,其机制尚不清楚。胚胎6~8周时,原始生殖细胞不断有丝分裂,细胞数增多,体积增大,称为卵原细胞(oogonia),约60万个。自胚胎11~12周开始卵原细胞进入第一次减数分裂,并静止于前期双线期,称为初级卵母细胞(primary oocyte)。胚胎16~20周时生殖细胞数目达到高峰,两侧卵巢共含600万~700万个(卵原细胞占1/3,初级卵母细胞占2/3)。胚胎16周至生后6个月,单层梭形前颗粒细胞围绕着停留于减数分裂双线期的初级卵母细胞形成始基卵泡(primordial follicle),这是女性的基本生殖单位,也是卵细胞储备的唯一形式。胎儿期的卵泡不断闭锁,出生时约剩200万个,儿童期多数卵泡退化,至青春期只剩下约30万个。
从青春期开始到绝经前,卵巢在形态和功能上发生周期性变化称为卵巢周期(ovarian cycle)。
1.卵泡发育和成熟 进入青春期后,卵泡由自主发育推进至发育成熟的过程依赖于促性腺激素的刺激。生育期每月发育一批(3~11个)卵泡,经过募集、选择,其中一般只有一个优势卵泡可达完全成熟,并排出卵子。其余的卵泡发育到一定程度通过细胞凋亡机制而自行退化,称卵泡闭锁。女性一生中一般只有400~500个卵泡发育成熟并排卵,仅占总数的0.1%左右。
卵泡的发育始于始基卵泡到初级卵泡的转化,始基卵泡可以在卵巢内处于休眠状态数十年。始基卵泡发育远在月经周期起始之前,从始基卵泡至形成窦前卵泡需9个月以上的时间(图3-1),从窦前卵泡发育到成熟卵泡经历持续生长期(1~4级卵泡)和指数生长期(5~8级卵泡),共需85日(图3-2),实际上跨越了3个月经周期。一般卵泡生长的最后阶段正常约需15日左右,是月经周期的卵泡期。

图3-1 成人卵巢内卵泡的生长发育及各级生长卵泡出现的比例
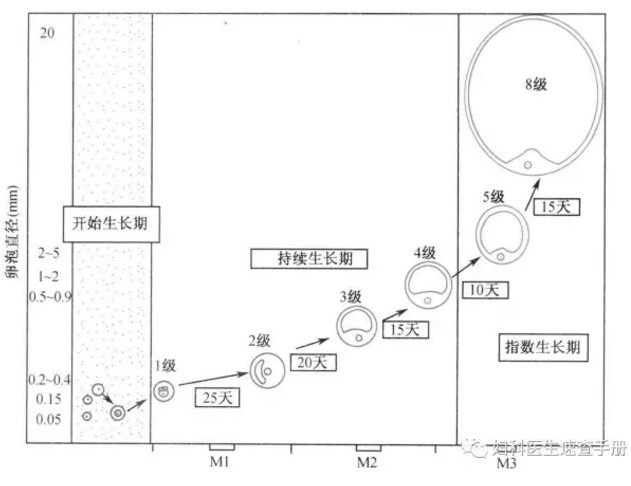
图3-2 卵泡生长速率示意图
根据卵泡的形态、大小、生长速度和组织学特征,可将其生长过程分为以下几个阶段(图3-3)。

图3-3 不同发育阶段的卵泡形态示意图
(1)始基卵泡:由停留于减数分裂双线期的初级卵母细胞被单层梭形前颗粒细胞围绕而形成。
(2)窦前卵泡(preantral follicle):始基卵泡的梭形前颗粒细胞分化为单层立方形细胞之后成为初级卵泡(primary follicle)。与此同时,颗粒细胞合成和分泌黏多糖,在卵子周围形成一透明环形区,称透明带(zona pellucida)颗粒细胞的胞膜突起可穿过透明带与卵子的胞膜形成缝隙连接,这些胞膜的接触为卵子的信息传递和营养提供了一条通道。最后初级卵泡颗粒细胞的增殖使细胞的层数增至6~8层(600个细胞以下),卵泡增大,形成次级卵泡(secondary follicle)。颗粒细胞内出现卵泡刺激素(follicle-stimulating hormone,FSH)、雌激素(estrogen,E)和雄激素(androgen,A)三种受体,具备了对上述激素的反应性。卵泡基底膜附近的梭形细胞形成两层卵泡膜,即卵泡内膜(theca interna)和卵泡外膜(theca externa)。卵泡内膜细胞出现LH受体,具备了合成甾体激素的能力。
(3)窦卵泡(antral follicle):在雌激素和FSH的协同作用下,颗粒细胞间积聚的卵泡液增加,最后融合形成卵泡腔,卵泡增大直径达500μm,称为窦卵泡。窦卵泡发育的后期,相当于前一卵巢周期的黄体晚期及本周期卵泡早期,血清FSH水平及其生物活性增高,超过一定阈值后,卵巢内有一组窦卵泡群进入了“生长发育轨道”,这种现象称为募集(recruitment)。约在月经周期第7日,在被募集的发育卵泡群中,FSH阈值最低的一个卵泡,优先发育成为优势卵泡(dominant follicle),其余的卵泡逐渐退化闭锁,这个现象称为选择(selection)。月经周期第11~13日,优势卵泡增大至18mm左右,分泌雌激素量增多,使血清雌激素量达到300pg/ml左右。不仅如此,在FSH刺激下,颗粒细胞内又出现了LH受体及PRL受体,具备了对LH、PRL的反应性。此时便形成了排卵前卵泡。
(4)排卵前卵泡(preovulatory follicle):为卵泡发育的最后阶段,亦称格拉夫卵泡(Graafian follicle)。卵泡液急骤增加,卵泡腔增大,卵泡体积显著增大,直径可达18~23mm,卵泡向卵巢表面突出,其结构从外到内依次为:1)卵泡外膜:为致密的卵巢间质组织,与卵巢间质无明显界限。
2)卵泡内膜:从卵巢皮质层间质细胞衍化而来,细胞呈多边形,较颗粒细胞大。此层含丰富血管。
3)颗粒细胞:细胞呈立方形,细胞间无血管存在,营养来自外周的卵泡内膜。
4)卵泡腔:腔内充满大量清澈的卵泡液和雌激素。
5)卵丘:呈丘状突出于卵泡腔,卵细胞深藏其中。
6)放射冠:直接围绕卵细胞的一层颗粒细胞,呈放射状排列。
7)透明带:在放射冠与卵细胞之间有一层很薄的透明膜,称透明带。
2.排卵 卵细胞和它周围的卵丘颗粒细胞一起被排出的过程称排卵(ovulation)。排卵过程包括卵母细胞完成第一次减数分裂和卵泡壁胶原层的分解及小孔形成后卵子的排出活动。排卵前,由于成熟卵泡分泌的雌二醇在循环中达到对下丘脑起正反馈调节作用的峰值(E2≥200pg/ml),促使下丘脑GnRH的大量释放,继而引起垂体释放促性腺激素,出现LH/FSH峰。LH峰是即将排卵的可靠指标,出现于卵泡破裂前36小时。LH峰使初级卵母细胞完成第一次减数分裂,排出第一极体,成熟为次级卵母细胞。在LH峰作用下排卵前卵泡黄素化,产生少量孕酮。LH/FSH排卵峰与孕酮协同作用,激活卵泡液内蛋白溶酶活性,使卵泡壁隆起尖端部分的胶原消化形成小孔,称排卵孔(stigma)。排卵前卵泡液中前列腺素显著增加,排卵时达高峰。前列腺素可促进卵泡壁释放蛋白溶酶,有助于排卵。排卵时随卵细胞同时排出的还有透明带、放射冠及小部分卵丘内的颗粒细胞。排卵多发生在下次月经来潮前14日左右。卵子可由两侧卵巢轮流排出,也可由一侧卵巢连续排出。卵子排出后,经输卵管伞部捡拾、输卵管壁蠕动以及输卵管黏膜纤毛活动等协同作用通过输卵管,并被运送到子宫腔。
3.黄体形成及退化 排卵后卵泡液流出,卵泡腔内压下降,卵泡壁塌陷,形成许多皱襞,卵泡壁的卵泡颗粒细胞和卵泡内膜细胞向内侵入,周围由结缔组织的卵泡外膜包围,共同形成黄体(corpus luteum)。卵泡颗粒细胞和卵泡内膜细胞在LH排卵峰的作用下进一步黄素化,分别形成颗粒黄体细胞及卵泡膜黄体细胞。两种黄体细胞内都含有胡萝卜素,该色素含量多寡决定黄体颜色的深浅。黄体细胞的直径由原来的12~14μm增大到35~50μm.在血管内皮生长因子(VEGF)作用下颗粒细胞血管化。排卵后7~8日(相当于月经周期第22日左右),黄体体积和功能达到高峰,直径1~2cm,外观黄色。正常黄体功能的建立需要理想的排卵前卵泡发育,特别是FSH刺激,以及一定水平的持续性LH维持。
若排出的卵子受精,黄体则在胚胎滋养细胞分泌的人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)作用下增大,转变为妊娠黄体,至妊娠3个月末才退化。此后胎盘形成并分泌甾体激素维持妊娠。
若卵子未受精,黄体在排卵后9~10日开始退化,黄体功能限于14日,其机制尚未完全明确,可能与其分泌的雌激素溶黄体作用有关,其作用由卵巢局部前列腺素和内皮素-Ⅰ所介导。黄体退化时黄体细胞逐渐萎缩变小,周围的结缔组织及成纤维细胞侵入黄体,逐渐由结缔组织所代替,组织纤维化,外观色日,称白体(corpus albicans)。黄体衰退后月经来潮,卵巢中又有新的卵泡发育,开始新的周期。
(三)卵巢性激素的合成及分泌
主要是雌激素(estrogen)和孕激素(progesterone),及少量雄激素(androgen),均为甾体激素(steroid hormone)。卵泡膜细胞为排卵前雌激素的主要来源,黄体细胞在排卵后分泌大量的孕激素及雌激素。雄激素(睾酮)主要由卵巢间质细胞和门细胞产生。 1.甾体激素的基本化学结构 甾体激素属类固醇激素。类固醇激素的基本化学结构为环戊烷多氢菲环。按碳原子的数目分为3组:含21个碳原子为孕激素,基本结构为孕烷核,如孕酮;含19个碳原子为雄激素,基本结构为雄烷核,如睾酮;含18个碳原子为雌激素,基本结构为雌烷核,如雌二醇、雌酮、雌三醇。
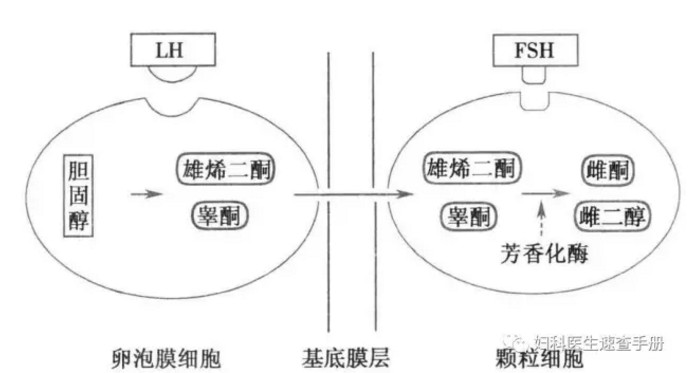
2.甾体激素的生物合成过程 卵巢甾体激素生物合成需要多种羟化酶及芳香化酶的作用,它们都属于细胞色素P450超基因家族。在LH的刺激下,卵泡膜细胞内胆固醇经线粒体内细胞色素P450侧链裂解酶催化,形成孕烯醇酮(pregnenolone),这是性激素合成的限速步骤。孕烯醇酮合成雄烯二酮有△4和△5两条途径。卵巢在排卵前以△5途径合成雌激素,排卵后可通过△4和△5两条途径合成雌激素。孕酮的合成是通过△4途径(图3-4)。卵巢雌激素的合成是由卵泡膜细胞与颗粒细胞在FSH与LH的共同作用下完成的:LH与卵泡膜细胞LH受体结合后可使胆固醇形成睾酮和雄烯二酮,后两者进入颗粒细胞内成为雌激素的前身物质;FSH与颗粒细胞上FSH受体结合后激活芳香化酶,将睾酮和雄烯二酮分别转化为雌二醇和雌酮,进入血液循环和卵泡液中。这就是Falck(1959年)提出的雌激素合成的两细胞-两促性腺激素学说(图3-5)。
图3-4 性激素的生物合成途径示意图图
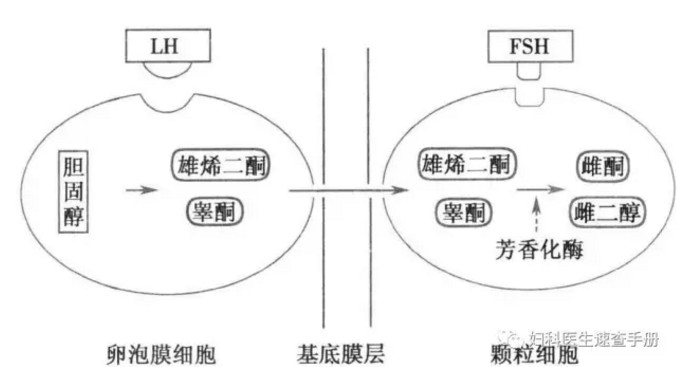
3-5 雌激素合成的两细胞-两促性腺激素学说示意图
3.甾体激素代谢 甾体激素主要在肝内代谢。雌二醇的代谢产物为雌酮及其硫酸盐、雌三醇、2-羟雌酮等,主要经肾脏排出;有一部分经胆汁排入肠内可再吸收入肝,即肝肠循环。孕激素主要代谢为孕二醇,经肾脏排出体外;睾酮代谢为雄酮、原胆烷醇酮,主要以葡萄糖醛酸盐的形式经肾脏排出体外。
4.卵巢性激素分泌的周期性变化
(1)雌激素:卵泡开始发育时,雌激素分泌量很少;至月经第7日卵泡分泌雌激素量迅速增加,于排卵前达高峰;排卵后由于卵泡液中雌激素释放至腹腔使循环中雌激素暂时下降,排卵后1~2日,黄体开始分泌雌激素使循环中雌激素又逐渐上升,约在排卵后7~8日黄体成熟时,循环中雌激素形成又一高峰。此后,黄体萎缩,雌激素水平急剧下降,在月经期达最低水平。
(2)孕激素:卵泡期卵泡不分泌孕酮,排卵前成熟卵泡的颗粒细胞在LH排卵峰的作用下黄素化,开始分泌少量孕酮,排卵后黄体分泌孕酮逐渐增加至排卵后7~8日黄体成熟时,分泌量达最高峰,以后逐渐下降,到月经来潮时降到卵泡期水平。
(3)雄激素:女性雄激素主要来自肾上腺。卵巢也能分泌部分雄激素,包括睾酮、雄烯二酮和脱氢表雄酮。卵巢内泡膜层是合成分泌雄烯二酮的主要部位,卵巢间质细胞和门细胞主要合成与分泌睾酮。排卵前循环中雄激素升高,一方面可促进非优势卵泡闭锁,另一方面可提高性欲。
5.卵巢性激素的生理作用
(1)雌激素的生理作用
1)子宫肌:促进子宫肌细胞增生和肥大,使肌层增厚;增进血运,促使和维持子宫发育;增加子宫平滑肌对缩宫素的敏感性。
2)子宫内膜:使子宫内膜腺体和间质增生、修复。
3)宫颈:使宫颈口松弛、扩张,宫颈黏液分泌增加,性状变稀薄,富有弹性,易拉成丝状。
4)输卵管:促进输卵管肌层发育及上皮的分泌活动,并可加强输卵管肌节律性收缩的振幅。
5)阴道上皮:使阴道上皮细胞增生和角化,黏膜变厚,并增加细胞内糖原含量,使阴道维持酸性环境。
6)外生殖器:使阴唇发育、丰满、色素加深。
7)第二性征:促使乳腺管增生,乳头、乳晕着色,促进其他第二性征的发育。
8)卵巢:协同FSH促进卵泡发育。
9)下丘脑、垂体:通过对下丘脑和垂体的正负反馈调节,控制促性腺激素的分泌。
10)代谢作用:促进水钠潴留;促进肝脏高密度脂蛋白合成,抑制低密度脂蛋白合成,降低循环中胆固醇水平;维持和促进骨基质代谢。
(2)孕激素的生理作用:孕激素通常是在雌激素作用的基础上发挥效应的。
1)子宫肌:降低子宫平滑肌兴奋性及其对缩宫素的敏感性,抑制子宫收缩,有利于胚胎及胎儿宫内生长发育。
2)子宫内膜:使增生期子宫内膜转化为分泌期内膜,为受精卵着床做好准备。
3)宫颈:使宫口闭合,黏液分泌减少,性状变黏稠。
4)输卵管:抑制输卵管肌节律性收缩的振幅。
5)阴道上皮:加快阴道上皮细胞脱落。
6)乳房:促进乳腺腺泡发育。
7)下丘脑、垂体:孕激素在月经中期具有增强雌激素对垂体LH排卵峰释放的正反馈作用;在黄体期对下丘脑、垂体有负反馈作用,抑制促性腺激素分泌。
8)体温:兴奋下丘脑体温调节中枢,可使基础体温在排卵后升高0.3~0.5℃。临床上可以此作为判定排卵日期的标志之一。
9)代谢作用:促进水钠排泄。
(3)孕激素与雌激素的协同和拮抗作用:孕激素在雌激素作用的基础上,进一步促使女性生殖器和乳房的发育,为妊娠准备条件,二者有协同作用;另一方面,雌激素和孕激素又有拮抗作用,雌激素促进子宫内膜增生及修复,孕激素则限制子宫内膜增生,并使增生的子宫内膜转化为分泌期。其他拮抗作用表现在子宫收缩、输卵管蠕动、宫颈黏液变化、阴道上皮细胞角化和脱落以及钠和水的潴留与排泄等方面。
(4)雄激素的生理作用1)对女性生殖系统的影响:自青春期开始,雄激素分泌增加,促使阴蒂、阴唇和阴阜的发育,促进阴毛、腋毛的生长。但雄激素过多会对雌激素产生拮抗作用,如减缓子宫及其内膜的生长和增殖,抑制阴道上皮的增生和角化。长期使用雄激素,可出现男性化的表现。雄激素还与性欲有关。
2)对机体代谢功能的影响:雄激素能促进蛋白合成,促进肌肉生长,并刺激骨髓中红细胞的增生。在性成熟期前,促使长骨骨基质生长和钙的保留;性成熟后可导致骨骺的关闭,使生长停止。可促进肾远曲小管对水、钠的重吸收并保留钙。
6.甾体激素的作用机制 甾体激素具有脂溶性,主要通过扩散方式进入细胞内,与胞质受体结合,形成激素-胞质受体复合物。靶细胞胞质中存在的甾体激素受体是蛋白质,与相应激素结合具有很强的亲和力和专一性。当激素进入细胞内与胞质受体结合后,受体蛋白发生构型变化和热休克蛋白(HSP)解离,从而使激素-胞质受体复合物获得进入细胞核内的能力,并由胞质转移至核内,与核内受体结合,形成激素-核受体复合物,从而引发DNA的转录过程,生成特异的mRNA,在胞质核糖体内翻译,生成蛋白质,发挥相应的生物效应。
(四)卵巢分泌的多肽激素
卵巢除分泌c甾体激素外,还分泌一些多肽激素、细胞因子和生长因子。
1.多肽激素 在卵泡液中可分离到三种多肽,根据它们对FSH产生的影响不同,分为抑制素(inhibin)、激活素(activin)和卵泡抑制素(follistatin,FS)。它们既来源于卵巢颗粒细胞,也产生于垂体促性腺细胞,与卵巢甾体激素系统一样,构成调节垂体促性腺激素合成与分泌的激活素-抑制素-卵泡抑制素系统。
(1)抑制素:由两个不同的亚单位(α和β)通过二硫腱连接,β亚单位再分为βA和βB,形成抑制素A(αβA)和抑制素B(αβB)。它的主要生理作用是选择性地抑制垂体FSH的产生,包括FSH的合成和分泌,另外,它也能增强LH的活性。
(2)激活素:由抑制素的两个β亚单位组成,形成激活素A(βAβA)、激活素AB(βAβB)和激活素B(βBβB)。近年来发现激活素还有其他亚单位,如βC、βD、βE等。激活素主要在垂体局部通过自分泌作用,增加垂体细胞的GnRH受体数量,提高垂体对GnRH的反应性,从而刺激FSH的产生。
(3)卵泡抑制素:是一个高度糖基化的多肽,它与抑制素和激活素的β亚单位具有亲和力。激活素与之结合后,失去刺激FSH产生的能力。卵泡抑制素的主要功能是通过自分泌/旁分泌作用,抑制FSH的产生。
2.细胞因子和生长因子 白细胞介素-Ⅰ、肿瘤坏死因子-α、胰岛素样生长因子、血管内皮生长因子、表皮生长因子、成纤维细胞生长因子、转化生长因子、血小板衍生生长因子等细胞因子和生长因子通过自分泌或旁分泌形式也参与卵泡生长发育的调节。





相关推荐:
·2019年妇产科主治医师考试辅导知识点(15) (2019-03-26 15:24:36)
·2019年妇产科主治医师考试辅导知识点(14) (2019-03-26 15:24:03)
·2019年妇产科主治医师考试辅导知识点(13) (2019-03-26 15:20:51)
·2019主管护师考试考点:合理使用抗生素的注意事项 (2019-03-25 14:10:26)
·2019主管护师考试考点:急性肺炎护理要点 (2019-03-25 14:06:26)
·免费真题 ·模考试题



实用文档 | 入党资料 | 入党申请书 | 入党志愿书 | 个人自传 | 转正申请书 | 思想汇报 | 个人简历 | 简历模板 | 简历封面 | 工作计划 | 工作总结 | 自我评测
个性评测 | 社交评测 | 事业评测 | 运势评测 | 报告 | 实习报告 | 工作总结 | 社会实践 | 心得体会 | 述职报告 | 调查报告 | 辞职报告
法律文书 | 合同范本 | 演讲范文 | 更多>>
英语学习 | 听力口语 | 阅读写作 | 翻译文化 | 趣味英语 | 学习方法 | 英文经典歌曲 | 每日课堂 | 空中英语 | 少儿英语 | 影视英语 | 英文歌曲 | 更多>>
作文大全 | 作文 | 小学 | 初中 | 高中 | 话题作文 | 考研 | 四六级 趣味作文 | 体裁作文 | 记叙文 | 议论文 说明文 | 应用文 | 读后感 | 作文素材 | 名言警句
优美段落 | 哲理故事 | 诗词赏析 | 成语知识 | 技巧 | 写作指导 | 作文点评 | 佳文赏析 | 写作基础 | 话题演练 | 作文教学 | 更多>>



 下载
下载
