| 第一章 药物化学结构与体内生物转化的关系 | |
| 第一节 药物的官能团化反应(第I相生物转化) | 第二节 药物的结合反应(第Ⅱ相生物结合) |
第一章 药物化学结构与体内生物转化的关系
基本概念
1.定义:在酶的作用下,将药物转变成极性分子,再排出体外的过程,称为药物代谢
2.研究目的:阐明药理作用特点、作用时程、产生毒副作用的原因
3.药物在体内代谢的化学变化类型(分类)
药物代谢的分类(分两相)
第I相:生物转化(官能团的反应)
药物分子进行氧化、还原、水解、羟基化,引入或使分子暴露出极性基团(羟基、羧基、巯基、氨基等)。
第II相:生物结合(结合反应)
I相的产物与体内内源性分子(葡萄糖醛酸、硫酸、甘氨酸、谷胱甘肽)共价键结合生成水溶性的物质,排出体外。
第一节 药物的官能团化反应(第I相生物转化)
九个标题,主要归为:氧化(羟基化)、还原、水解
一、含芳环的药物(氧化)
芳环的 氧化,生成酚类化合物。一般在立体位阻小的位置
例:苯妥英
一个芳环羟基化

二、含烯键和炔键的药物(氧化)
氧化为环氧化物,再转化为二羟基化合物
例:卡马西平
经环氧化反应(活性成分),再进一步转化为二羟基化合物

三、含饱和碳原子的药物(氧化)
1.氧化成羟基
2.长碳链端基的甲基进行ω氧化生成羧基,ω—1氧化为羟基化合物
3.羰基α碳:易氧化为羟基化合物
例:地西泮羰基α碳的羟基化反应

四、含卤素的代谢(氧化脱卤)
一部分卤代烃与谷胱甘肽结合排出,其余的氧化脱卤,生成活性中间体,产生毒性。
例:氯霉素二氯乙酰基氧化为酰氯,产生毒性
五、胺类药物
N—脱烷基,脱胺,N—氧化
例:普萘洛尔

叔胺和含氮芳杂环类:N—氧化反应

六、含氧的药物
O—脱烷基,醇的氧化,酮的还原
例醚类药物:O—脱烷基
可待因

酮经还原反应生成醇
例:美沙酮被还原为美沙醇,引入手性碳

七、含硫的药物
与氧类似,S—脱烷基,硫氧化,硫还原
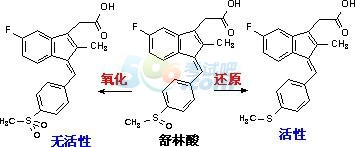
例:舒林酸是前体药物,在体内还原生成硫醚化合物,具有活性。
八、含硝基的药物(还原)
1.硝基经还原生成芳香胺类
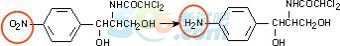
2.中间经过羟胺中间体,可致癌和产生细胞毒
九、酯和酰胺药物的代谢(水解)
1.酯和酰胺的代谢途径为水解反应
2.酰胺较酯水解较慢
3.酯和酰胺的可水解性可用于前药设计





| 执业药师QQ群: |
|---|
相关推荐:
·2018年执业药师《中药专业知识二》知识讲解(29) (2018-05-09 14:58:29)
·2018年执业药师《中药知识一》复习备考笔记(30) (2018-05-09 14:51:54)
·2018年执业药师《中药知识一》复习备考笔记(29) (2018-05-09 14:42:18)
·2018年执业药师药事管理与法规复习资料(30) (2018-05-09 14:34:24)
·2018年执业药师药事管理与法规复习资料(29) (2018-05-09 14:30:22)
·免费真题 ·模考试题


- 药学专二
- 药学综合
- 中药专一
- 中药专二
实用文档 | 入党资料 | 入党申请书 | 入党志愿书 | 个人自传 | 转正申请书 | 思想汇报 | 个人简历 | 简历模板 | 简历封面 | 工作计划 | 工作总结 | 自我评测
个性评测 | 社交评测 | 事业评测 | 运势评测 | 报告 | 实习报告 | 工作总结 | 社会实践 | 心得体会 | 述职报告 | 调查报告 | 辞职报告
法律文书 | 合同范本 | 演讲范文 | 更多>>
英语学习 | 听力口语 | 阅读写作 | 翻译文化 | 趣味英语 | 学习方法 | 英文经典歌曲 | 每日课堂 | 空中英语 | 少儿英语 | 影视英语 | 英文歌曲 | 更多>>
作文大全 | 作文 | 小学 | 初中 | 高中 | 话题作文 | 考研 | 四六级 趣味作文 | 体裁作文 | 记叙文 | 议论文 说明文 | 应用文 | 读后感 | 作文素材 | 名言警句
优美段落 | 哲理故事 | 诗词赏析 | 成语知识 | 技巧 | 写作指导 | 作文点评 | 佳文赏析 | 写作基础 | 话题演练 | 作文教学 | 更多>>



 下载
下载









